生物扫描电子显微镜(SEM)
 仪器型号:
HITACHI SU8010;HITACHI SU3500;Zeiss Gemini 300;FEI Nova Nano 450
仪器型号:
HITACHI SU8010;HITACHI SU3500;Zeiss Gemini 300;FEI Nova Nano 450
 预约次数:
31次
预约次数:
31次
 服务周期:
3.5-12.0
服务周期:
3.5-12.0
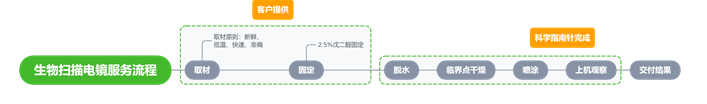
生物扫描电镜主要利用二次电子成像拍摄材料的表面三维形貌情况,拍摄照片为黑白照片;一般用来观察细胞外表面的变形以及受损情况等,也可以观察材料在细胞表面的分布情况,广泛应用于检测生物样品、非均相有机材料、无机材料等微米、纳米范围内的表面特征。同时,生物透射电镜是观察和研究超微结构的重要工具,可用于观察细胞整体结构、亚细胞结构。生物细胞样品内部形态观察建议用专门应用于生物样品观察的透射电镜,其电压在80-120kv可以降低生物样品因高能电子束辐射而损伤的影响,同时依赖于生物样品制备技术的发展,如超薄切片技术、负染色技术、冷冻制样技术、细胞化学技术等,广泛应用于组织学、细胞学、病毒学、病理学及材料学等多个学科的研究中,如常用来观察细胞整体结构、细胞膜细胞壁细胞器的变化、材料进入细胞内部的分布情况、细胞应付外界刺激产生的自噬小体,以及外界生物入侵的侵染结构等等。
送样方式:
可接收固定好的细胞/组织样品并附有详细送检要求的送样单
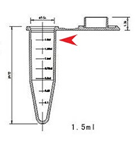
①需要您提供的样品:收集细胞/组织取样(新鲜迅速取材),置于1.5ml离心管内,加入2.5%的戊二醛溶液(固定液加满离心管,使样品完全浸没在固定液中),放置于4℃保存,请不要倒弃固定液,一般固定12h后可寄送(务必采用1.5ml离心管寄送)。
②打印填写完整的预约单、送样单和样品一起寄送。
样品取材及固定常用方法:
细胞类 | 106以上的细胞,用细胞刮刀刮下来,1500-3000转离心,5-10min,收集细胞于1.5ml或2ml离心管,管底肉眼可见2-3粒大米状样品,如果细胞量很多,把细胞团块用细针尖挑成几个小团块,弃上清,沿管壁缓慢加入4℃预冷的固定液,固定液完全浸没样品,可放置于4°C保存。 |
组织类 | 新鲜取材,取材位置准确,组织大小尽量在1-2mm³,离体取材后请尽快投入4℃预冷的固定液中,固定液完全浸没组织,可放置于4°C保存。 |
细菌类 | 吸取OD0.5-0.8的培养物,离心后弃培养基,收集菌体沉淀于管底黄豆大小,可以用PBS洗1-2次,齐上清,沿管壁缓慢加入4℃预冷的固定液,固定液完全浸没样品,可放置于4°C保存。 |
*固定液的量请参考上图,加至箭头所示位置 |
*如样品取材及固定有疑问请及时与科奥工作人员沟通 |
服务周期:
一般为样品接收后的2周左右,如遇法定假期需要顺延,具体实验周期及送样时间请与科奥工作人员沟通确认,谢谢!
交付内容:
每样提供8张拍摄图片(不提供分析服务),如需照片数量超过8张将产生额外费用;
结果反馈请在测试完成一周内,不建议回收样品,如有需要请提前反馈给科奥工作人员。
市售25%戊二醛水溶液 10ml
0.2M磷酸盐缓冲液(pH7.0) 50ml
蒸馏水加至 100ml
A液:Na2HPO4·H2O 31.61g,或者Na2HPO4·7H2O 53.63g,或者Na2HPO4·12H2O 71.64g,加蒸馏水至1000ml
B液:NaH2PO4·H2O 27.6g,或者NaH2PO4·2H2O 31.21g,加蒸馏水至1000ml
0.2M,pH7.0磷酸缓冲液= A液61ml+B液39ml(合起来是100ml)
新鲜取材后用2.5%戊二醛固定液固定样本,4℃过夜放置,倒掉2.5%戊二醛固定液,用0.1M,pH7.0的磷酸缓冲液漂洗样品三次,每次15min;用1%的锇酸溶液固定样品1-2h;小心取出锇酸废液,用0.1M,pH7.0的磷酸缓冲液漂洗样品三次,每次15min;用梯度浓度(包括30%,50%,70%,80%,90%和95%五种浓度)的乙醇溶液对样品进行脱水处理,每种浓度处理15min,再用100%的乙醇处理两次,每次20 min。用乙醇与醋酸异戊酯的混合液(V/V=1/1)处理样品30min,再用纯醋酸异戊酯处理样品1h或放置过夜。临界点干燥。镀膜,观察。处理好的样品在扫描电镜中观察。


 19128689285
19128689285